L'idée que toutes les substances dans le monde sont composées d'atomes est née au 5ème siècle avant JC, lorsque le penseur grec antique Démocrite a suggéré que tout ce qui existe est composé des plus petites particules en mouvement. On ne peut que supposer que ce n'est pas sans signification. Pendant de nombreux siècles après Démocrite, des atomes ont été périodiquement rappelés, mais cette hypothèse n'était pas populaire dans ces temps reculés. Au XIXe siècle, l'hypothèse atomique réapparaît à l'horizon scientifique.
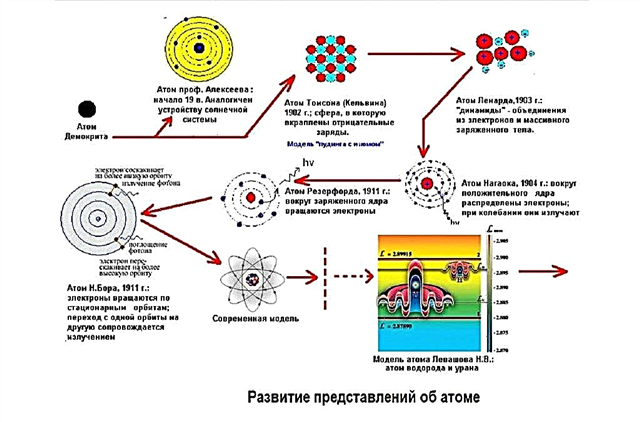
Modèles de structure d'atomes

Les scientifiques recherchaient un modèle qui pourrait décrire de manière satisfaisante l'image du monde réel. L'atome s'est avéré être un modèle très approprié. Bien que les atomes ne soient pas visibles, mais en leur permettant d'exister, les scientifiques pourraient expliquer ce qu'ils ont observé dans leurs expériences et dans la nature.
Les scientifiques étaient convaincus de l'existence d'atomes bien avant de pouvoir le prouver. Le modèle a fonctionné, bien que personne ne puisse prouver sa vérité. Par exemple, au début du 19e siècle, le scientifique anglais John Dalton, étudiant les lois des réactions chimiques, a découvert que deux substances réagissent toujours chimiquement dans la même proportion constante. Par exemple, la combinaison d'une partie d'oxygène et de deux parties d'hydrogène donne de l'eau.
Cela suggérait que les atomes d'une substance, de masse égale les uns aux autres, se joignaient aux atomes d'une autre substance (c'est-à-dire avec des atomes d'une masse différente). Dans le cas de la formation d'eau, un atome d'oxygène se combine avec deux atomes d'hydrogène.Le modèle atomique a aidé à comprendre exactement ce que Dalton a observé dans ses expériences. Il existe d'autres preuves simples de l'existence d'atomes.
Si vous regardez au microscope les particules de pollen en suspension dans l'eau, vous pouvez voir qu'elles font des mouvements chaotiques. Pourquoi? Les scientifiques ont suggéré que cela peut être dû au fait que les particules de pollen entrent en collision avec de nombreux atomes ou groupes d'atomes que les scientifiques ont appelés molécules (par exemple, les particules dans l'eau entrent en collision avec les molécules d'eau).
En quoi consiste un atome?
Les scientifiques qui étaient d'accord avec la théorie atomique pensaient qu'un atome se compose de petites particules chargées électriquement - positives et négatives, qui, lorsqu'elles sont combinées dans un atome, comme dans une boule, se neutralisent et rendent l'atome dans son ensemble électriquement neutre. Mais en 1907, le physicien anglais Ernest Rutherford, avec ses expériences, a prouvé que ce n'est pas tout à fait vrai.
Expérience Rutherford
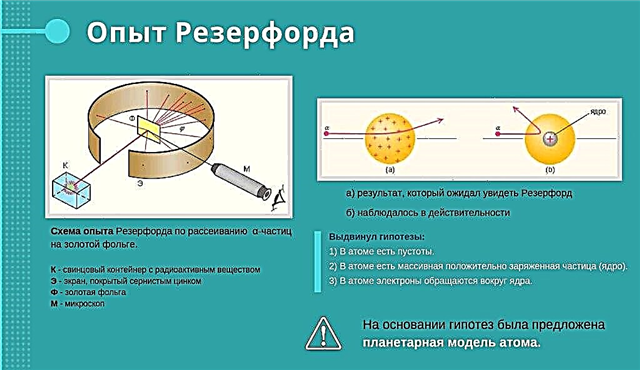
Rutherford a bombardé une feuille d'or avec un faisceau à grande vitesse de particules chargées positivement. Il croyait que les particules passeraient à travers la feuille. Certaines particules chargées positivement ont traversé la feuille. Et certains ne pouvaient pas faire ça. De plus, ils ont ricoché sur l'expérimentateur, comme si une force cachée dans le papier d'aluminium les avait repoussés. Rutherford était surpris. Il a dit que c'était la même chose que de commencer à brûler le pot sur du papier fibreux et de voir soudain comment le pot s'envole du front du potier.
Modèle d'atome planétaire - noyau atomique
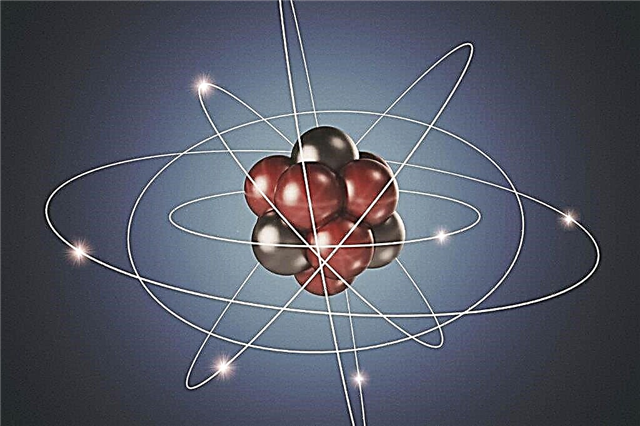
Les expériences de Rutherford ont aidé à confirmer l'hypothèse atomique et à comprendre le fonctionnement de l'atome. Il est devenu clair que les particules positives et négatives ne sont pas réparties uniformément dans l'atome. S'il en était ainsi, les particules chargées positivement dans l'expérience de Rutherford ne seraient pas repoussées avec une telle force. Par conséquent, le noyau d'un atome n'est pas neutre. Au milieu de l'atome, il y a une boule dense de particules, c'est-à-dire qu'au milieu, qui est appelé le noyau de l'atome, se trouvent des protons chargés positivement et des neutrons neutres.
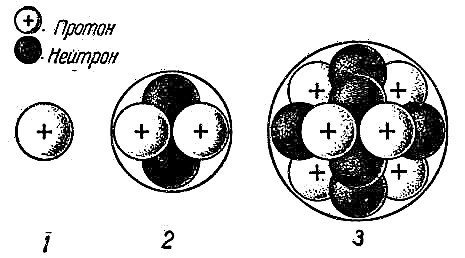
À une distance considérable du noyau, des particules chargées négativement - des électrons - tournent autour de ses orbites autour de lui. Puisqu'une charge positive a une valeur égale à une charge négative, l'atome dans son ensemble est électriquement neutre. Il ne porte aucun frais.
Mais le noyau lui-même est la concentration d'une charge positive. Beaucoup de particules positives dans l'expérience de Rutherford ont volé trop près du noyau chargé positivement d'un atome d'or. Comme les charges positives se repoussent mutuellement, ces particules ont volé vers l'expérimentateur. Cela lui a donné l'idée de la façon dont les atomes sont réellement organisés.
Quarks
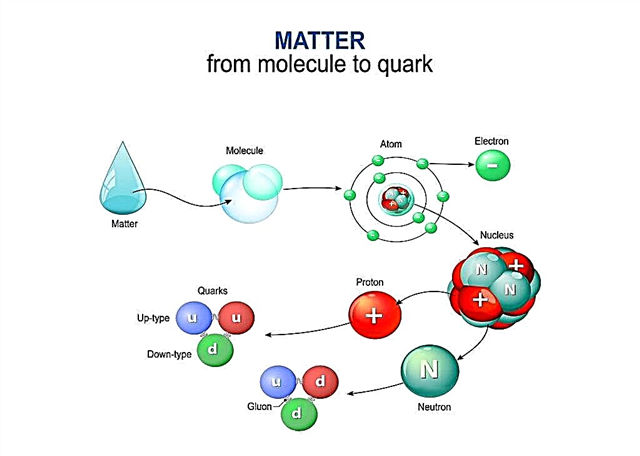
Les protons et les neutrons sont des particules qui, bien que petites elles-mêmes, sont constituées de particules encore plus petites appelées quarks. Aujourd'hui, les scientifiques pensent que les protons et les neutrons sont constitués de particules encore plus petites appelées quarks.
Les quarks sont un nouveau modèle qui explique mieux le comportement des atomes dans le monde réel. Et tout comme les scientifiques avaient auparavant recherché des preuves expérimentales de l'existence d'atomes, ils recherchent maintenant de véritables preuves de quarks.